- Produitsarrow
- Produits
Sciences du Vivantarrow
- Sciences du Vivant
- Préparation d’Échantillons – Homogénéisateursarrow
- Préparation d’Échantillons – Homogénéisateurs
- Homogénéisateur Broyeur de Tissus Precellys Evolution Touch
- Homogénéisateur Precellys 24 Touch
- Kits d’Extraction d’Acides Nucléiques Precellys
- Kit de Dissociation Multi-Tissus Precellys
- Kits de Lyse Cellulaire/Tissulaire Precellys
- Homogénéisateur Personnel Minilys
- Cryolys Evolution
- Bioréactifs & Biomarqueursarrow
- Biocollecteurs d’Airarrow
- Applicationsarrow
- Applications
- Acetylcholinesterase (Ache)
- Extraction de métabolites
- Extraction de protéines
- Extraction d’ARN
- Extraction ADN
- Choisir votre kit de lyse
- Kit Emulsion
- PCR et RT-PCR
- Séquençage à haut débit (NGS)
- Technique du Western Blot
- ELISA
- Chromatographie
- Spectrométrie de masse
- Extraction des drogues
- Détection des bactéries
- Détection des champignons
- Détection des virus
- Décontamination d’environnements
- Détection des allergènes
- Systèmes à la demande
- Systèmes à la demande
- BEC SARS-COV-2 RT-LAMP KIT
- Electroporateur
- Production automatisée de cellules souches cardiaques
Détection Nucléaire & Radioprotectionarrow
- Détection Nucléaire & Radioprotection
- Solutions de Radioprotectionarrow
- Solutions de Radioprotection
- Contaminamètres
- Radiamètres
- Dosimètres et Systèmes de Dosimétrie
- BAB A7
- Surveillance Radiologique de l’Environnementarrow
- Surveillance Radiologique de l’Environnement
- GammaTRACER, Sonde Gamma
- SpectroTRACER, Sonde Spectrométrique
- BAB E
- Portiques de Détection de la Radioactivitéarrow
- Portiques de Détection de la Radioactivité
- SaphyGATE G
- SaphyGATE GN
- Surveillance Professionnelle du Radon
- Surveillance Professionnelle du Radon
- AlphaGUARD, Moniteur Radon
- AlphaE – Appareil de Mesure du Radon
- Services
- Applicationsarrow
- Systèmes à la demande
NRBCarrow
Surveillance et Protectionarrow
- Surveillance & Protection
- Capteurs déposés UGSarrow
- Capteurs déposés UGS
- Flexnet – Plateforme sans Fil de Surveillance et de Protection
- Optroniquearrow
- Optique
- Composants
- Composants
- Composants optiques hautes performances
- Applicationsarrow
- Systèmes à la Demandearrow
- Systèmes de Surveillance et de Protection Sur-Mesure
- Surveillance périmétrique du Système de Pose Rapide de Travures (SPRAT) de CNIM
- Surveillance & collecte du renseignement avec CamSIGHT LP intégré à la solution Flexnet
- Surveillance jour/nuit longue portée avec CamSIGHT LP et le ballon captif White Hawk
- Amélioration de la vision pilote sur le Scarabée – véhicule de reconnaissance de combat d’ARQUUS
Gestion des Déchets Hospitaliersarrow
- Gestion des Déchets Hospitaliers
- Systèmes de Traitements des DASRIarrow
- Systèmes de Traitements des DASRI
- Sterilwave 100
- Sterilwave 250
- Sterilwave 440
- Détection de la Radioactivité dans les Déchets Médicauxarrow
- Détection de la Radioactivité dans les Déchets Médicaux
- Contaminamètres
- Portiques de Détection de la Radioactivité
- Applicationsarrow
Spatial & Grands Instruments Scientifiquesarrow
- Spatial & Grand Instruments Scientifiques
- Spatial
- Fusionarrow
- Astronomiearrow
- Synchrotron / Rayons Xarrow
- Synchrotron / Rayons X
- Miroirs X
- Courbeurs de Miroirs X (benders)
- Systèmes KB (Kirkpatrick-Baez)
- Expertisearrow
- Ressourcesarrow
- Actualités
- À proposarrow
- Contact
Extraction de protéines
L’extraction des protéines est une étape clé pour les méthodes analytiques telles que le Western Blot et les tests enzymatiques. Dans cette page, les meilleurs scientifiques de Bertin ont partagé leurs conseils de bonnes pratiques pour améliorer votre protocole d’homogénéisation pour un large éventail de tissus, préserver l’intégrité des protéines de vos échantillons, obtenir un rendement optimal.
Les protéines sont des macromolécules constituées de longues chaînes d’acides aminés, dont font partie les enzymes, les protéines de signalisation cellulaire, les protéines de liaison aux ligands et les protéines du cytosquelette. L’extraction des protéines est la première étape de la plupart des méthodes de recherche en protéomique (p. ex., Western Blot, SDS-PAGE, spectrométrie de masse) ainsi que de l‘extraction de protéines. De nombreuses techniques ont été développées pour maximiser le rendement et la pureté des protéines extraites pour des échantillons tels que les tissus animaux ou des cellules en culture. Pour obtenir un rendement de protéines élevé, les échantillons (p. ex. les tissus végétaux et animaux, les cellules cultivées) doivent être homogénéisés de manière uniforme et efficace. Cela peut s’avérer difficile, car de nombreux échantillons contiennent des enzymes dégradant les protéines (protéases) ainsi que d’autres substances interférentes (p. ex., des kératines, des composés phénoliques, des lipides et des acides organiques). Grâce à la technologie de bead-beating 3D – la référence en matière de lyse mécanique – les homogénéisateurs Precellys peuvent homogénéiser tous les types de tissus et de cellules et garantir l’obtention d’un haut rendement et de protéines de haute qualité.
Ci-dessous, nos meilleurs scientifiques ont partagé leurs meilleurs conseils pour l’homogénéisation avec la gamme de produits Precellys afin de maximiser la récupération de protéines de haute qualité.
Conseils pour réussir votre extraction de protéines
Choix du tampon et ratio mg de tissu/volume du tampon de lyse
La composition du tampon d’homogénéisation doit être ajustée en fonction du type d’échantillon, de l’emplacement de la protéine d’intérêt, du rendement requis et de la nature de l’analyse en aval. En général, un tampon RIPA peut être un bon point de départ pour l’optimisation (150 mM NaCl, 1 % NP-40, 0,25 % Na-désoxycholate, 50 mM Tris-HCl [pH 7,4]). Selon les biotests, des détergents tels que le SDS peuvent être ajoutés au tampon pour améliorer la récupération des protéines solubles.
En fonction de l’application en aval, l’ajout d’inhibiteurs de phosphatases et de protéases est recommandé pour empêcher la dégradation et/ou la déphosphorylation des protéines. L’équipe du département Life Science de Bertin a développé les kits Protein Safe, des kit de lyse innovants contenant un mélange d’inhibiteurs de protéase (voir illustration 2). Il est à noter que pour certaines applications telles que la spectrométrie de masse, les inhibiteurs de protéase doivent être utilisés avec une grande prudence car ils peuvent interférer avec les résultats. Nous vous recommandons d’utiliser nos kits de lyse standard plutôt que les kits Protein Safe dans le cas d’échantillons destinés à l’analyse par spectrométrie de masse.
Un autre facteur important est de trouver un bon ratio (mg de tissu/µl de tampon de lyse) entre la quantité de tissu à homogénéiser et le volume de tampon de lyse ajouté dans le tube d’homogénéisation. Une surcharge de tissu dans le tube peut conduire à une homogénéisation de faible qualité ou incomplète. D’autre part, ajouter trop de tampon de lyse entraînera des échantillons sur-dilués non exploitables. En fonction de l’échantillon de tissu sur lequel vous travaillez, un bon point de départ pour le ratio tissu/tampon peut être trouvé dans le tableau ci-dessous.
| Tissue sample | Weight mg | Volume μl | Lysing kit | Tube format | Hints |
|---|---|---|---|---|---|
| Soft tissue: Liver, Brain, Spleen | 80-100 mg | 700 μl – 1ml | CK14 | 2 ml | Short homogenization cycles |
| Elastic tissue (skin, intestine) and tumors | 30-50 mg | 500 μl | CK28R, CKMix50R R = reinforced tubes |
2 ml | *** Do not submit elastic tissue and tumors as whole chunk, chop of tissue with scalpel in small pieces for good quality homogenates** |
| Hard tissue. Bones, cartilage | 50-100 mg | 700 μl | CK28R, CKMix50, MK28R | 2 ml |
Contrôle de la température
Les protéines sont des molécules thermosensibles, et en tant que telles, doivent être protégées contre une surchauffe excessive lors de l’homogénéisation. Par conséquent, les protocoles combinant des vitesses d’homogénéisation faibles et un temps d’homogénéisation court (<15 s) inférieurs doivent être privilégiés. Le Cryolys Evolution permet un contrôle précis de la température des échantillons lors de chaque cycle du Precellys.
Conseils pour le contrôle de la température
Avant l’homogénéisation, nous vous recommandons de placer les tubes de votre Precellys sur de la glace et de refroidir votre tampon de lyse. Pour les travaux sur les protéines, il est préférable d’avoir des pauses d’au moins une minute entre les cycles d’homogénéisation, ou d’utiliser une unité de refroidissement Cryolys à 4°C.
Lors de la première mise en place du protocole d’homogénéisation de vos échantillons, il est bon de vérifier visuellement l’efficacité de l’homogénéisation après le deuxième cycle en examinant la consistance de l’homogénat dans le tube. Une fois que le liquide à l’intérieur du tube est homogène, les cycles d’homogénéisation doivent être arrêtés.
Important : ne congelez pas les tubes Precellys avec de la glace carbonique ou de l’azote liquide avant l’homogénéisation, car cela fragiliserait le matériau du tube et qui pourrait ensuite se casser pendant le processus d’homogénéisation.
Découvrez le kit de lyse Protein Safe en vidéo
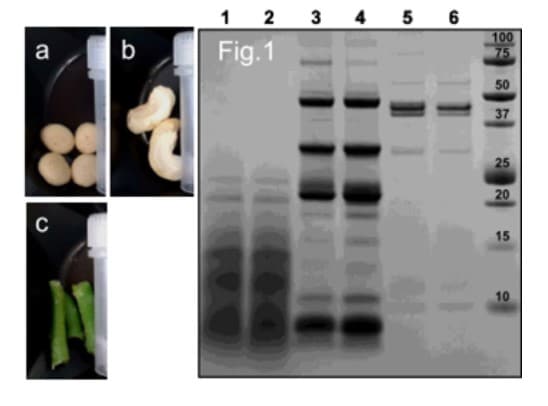
Figure 1 : analyse SDS-PAGE d’échantillons alimentaires homogénéisés avec le Precellys Evolution, avec ou sans ajout de PBS pH 7,4.
1 – Biscuits pour chiens homogénéisés avec du PBS pH 7,4 ;
2- Homogénéisation des biscuits pour chiens sans PBS pH 7,4 ;
3- Homogénéisation de noix de cajou avec du PBS pH 7,4 ;
4- Homogénéisation de noix de cajou sans PBS pH 7,4 ;
5- Homogénéisation de haricots verts avec du PBS pH 7,4 ;
6- Homogénéisation de haricots verts sans PBS pH 7,4.
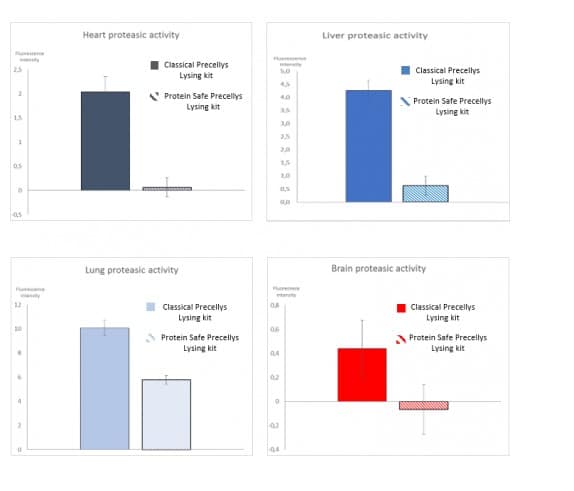
Figure 2 : Impact du kit de lyse Protein Safe sur l’activité des protéases lors de l’homogénéisation des tissus animaux avec le Precellys.
Les différents types de tissus (foie, cerveau, cœur et poumon) ont été coupés en morceaux avant l’homogénéisation. 50 mg d’échantillon ont ensuite été placés dans des tubes de lyse CK14 Protein Safe ou dans des tubes de lyse CK14 standards. Le volume a ensuite été complété avec 1,6 ml de tampon. Les tubes ont été placés sur le Precellys® Evolution équipé du module Cryolys® Evolution et traités à l’aide d’un programme d’homogénéisation générique. 400 µl de l’homogénat obtenu ont ensuite été transférés dans un nouveau tube pour procéder à l’analyse de l’activité des protéases. Le test utilisé est basé sur l’incubation de l’homogénat avec un substrat marqué à la résofurine par des protéases universelles. Les protéases actives dégradent ce substrat et libèrent une molécule fluorescente. Le niveau de fluorescence détecté sur l’échantillon par le fluorimètre est donc lié à l’activité des protéases. Dans le cas où les protéases sont inactives (inhibiteurs Protein Safe), la réaction ne peut pas se produire et aucune fluorescence ou une faible fluorescence est observée. Les niveaux de fluorescence reflétant les niveaux d’activité des protéases ont été mesurés dans les différents échantillons en suivant la méthode décrite précédemment. Les différents niveaux d’activité mesurés pour un même échantillon extrait avec le kit de lyse classique Precellys® et le kit de lyse Protein Safe sont représentés dans les illustrations 1 à 4 pour le cœur, le foie, les poumons et le cerveau.
DES QUESTIONS ? CONTACTER UN EXPERT
Remplissez ce formulaire pour être rappelé par notre équipe commerciale.