Détection des virus
La détection de virus dans des aérosols est une entreprise notoirement difficile. Ici, nos scientifiques ont partagé leurs conseils de bonnes pratiques pour utiliser les échantillonneurs d’air Coriolis pour monitorer la présence de virus dans divers types d’environnements.
La pandémie de la Covid-19 a dévoilé la vulnérabilité de nos systèmes de soins de santé face à des infections virales sans traitement connu. Il est essentiel de comprendre le comportement de transmission des virus aéroportés afin de concevoir des mesures de prévention et de contrôle pour gérer les pandémies. Une condition préalable est le développement de solutions fiables de surveillance de l’environnement pour contrôler la présence de virus dans l’air. Bertin Technologies a développé des échantillonneurs d’air qui peuvent être utilisés pour la détection et la surveillance des virus aéroportés dans un grand nombre d’environnements, des hôpitaux aux immeubles de bureaux : les échantillonneurs d’air Coriolis.
La détection de virus dans des échantillons d’air présente de nombreux défis : contrairement à d’autres microorganismes, les virus sont présents dans l’air dans des proportions très faibles, ce qui se traduit par la nécessité d’échantillonner une quantité d’air relativement importante pour avoir des résultats d’analyse fiables – quelques m3. L’intégrité des particules doit également être maintenue à chaque étape du protocole afin d’obtenir des estimations fiables de la viabilité du virus. Les dispositifs classiques d’échantillonnage de l’air présentent souvent l’inconvénient d’avoir de faibles débits d’air, ce qui se traduit par un long processus d’échantillonnage des virus.
Sur cette page, nos scientifiques ont partagé leurs conseils pour la détection de virus dans l’air avec les biocollecteurs d’air Coriolis.
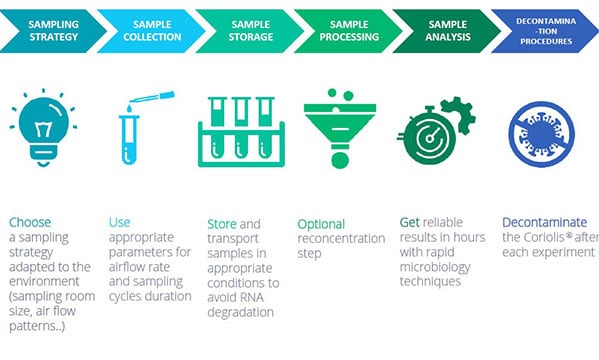
Bonnes pratiques pour la détection des virus dans des échantillons d’air à l’aide des échantillonneurs d’air Coriolis
1/ STRATÉGIE D’ÉCHANTILLONNAGE : choisissez une stratégie d’échantillonnage adaptée à l’environnement de travail (taille de la salle d’échantillonnage, flux d’air, etc.)
Il existe de nombreuses stratégies d’échantillonnage possibles pour le positionnement du Coriolis, en fonction de la disposition de la salle et de la concentration des virus dans l’air. Pour les environnements hospitaliers, le positionnement optimal de l’appareil est à une distance approximative de 1 mètre du lit du patient et à environ la même hauteur que la tête du patient. Si des échantillons d’air sont prélevés en plusieurs points de la chambre d’un patient, il est préférable de commencer à la distance la plus éloignée du patient et de progresser vers des positions plus proches. Pour une récupération optimale des particules, l’appareil doit toujours être placé sur la trajectoire du flux d’air dans la pièce.
Lors de l’utilisation de l’option Long Time Monitoring, il est préférable d’utiliser de l’eau stérile pour le liquide de collecte (ou un mélange d’eau stérile et de milieu de culture), plutôt que du PBS, afin d’éviter d’augmenter la concentration en sel dans le cône.
2/ PRÉLEVEZ LES ÉCHANTILLONS D’AIR en utilisant les paramètres adéquats pour le débit d’air et la durée des cycles d’échantillonnage.
- Débit d’air
Il a été montré que les échantillonneurs avec un débit supérieur à 200 L/min peuvent avoir tendance à dégrader le virus à ARN lors du prélèvement. Pour cette raison, nous recommandons d’utiliser le Coriolis Micro avec un débit d’air de 200 L/min ou moins pour les études de virus. Le Coriolis Compact peut être utilisé à 50 L/min. - Durée d’échantillonnage
Les virus étant le plus souvent présents dans l’air à une concentration très faible, la méthodologie expérimentale de la plupart des études implique le prélèvement d’au moins 1m3 d’air lors de chaque expérience, ce qui correspond à une durée d’échantillonnage d’au moins 5 min à une vitesse de 200 L/min. Lorsque cela est possible, une durée d’échantillonnage plus élevée doit être privilégiée pour prélever le volume d’air maximal possible, idéalement de 20 à 30 min à 200 L/min. Le Coriolis µ peut recueillir de l’air pendant 1 heure maximum sur batterie, et jusqu’à 6 heures avec l’option Long Time Monitoring qui fonctionne sur prise électrique. Le Coriolis Compact peut être utilisé jusqu’à 8 heures sur batterie. - Liquide d’échantillonnage
Les surfactants tels que le Triton peuvent affecter l’intégrité de la plupart des membranes virales. Par conséquent, nous recommandons de ne pas ajouter de surfactant au liquide de prélèvement. Le liquide de prélèvement optimal pour l’échantillonnage d’aérosols comportant des particules virales est le PBS. Un milieu de culture tel que le DMEM ou le MEM peut également être une bonne alternative a. D’autre part, la plupart des solutions RNA shield doivent être évitées en raison de vitesses d’évaporation élevées.
La plage de volume de liquide d’échantillonnage de départ recommandée est comprise entre 5 et 15 ml.
Lors de l’utilisation de l’option Long Time Monitoring, il est préférable d’injecter de l’eau stérile (ou un mélange d’eau stérile et de milieu de culture), plutôt que du PBS, afin d’éviter d’augmenter la concentration en sel dans le cône.
Avec le Coriolis Compact, le prélèvement est réalisé à sec. Les particules biologiques peuvent être récupérées en ajoutant le volume souhaité de tampon dans le cône, ce qui peut permettre d’obtenir des échantillons hautement concentrés.
3/ CONSERVATION DES ÉCHANTILLONS : conservez et transportez les échantillons dans des conditions adéquates pour éviter la dégradation de l’ARN
Avant de les transporter, les échantillons doivent être transférés des cônes vers des tubes de stockage appropriés. Les échantillons peuvent être conservés jusqu’à 24 heures à 4°C. Pour un stockage à long terme, ils peuvent être congelés dans des cryotubes à -20°C ou -80°C.
4/ TRAITEMENT DES ÉCHANTILLONS : étape de reconcentration facultative
Pour obtenir une solution finale à une concentration adaptée la plupart des protocoles nécessitent une étape de reconcentration avec un dispositif de filtration tangentielle, tel que l’Amicon 100 kDa Amicon Ultra-15 (Millipore). Cependant, dans les environnements où la concentration de virus est suffisamment élevée, cette étape peut être omise en choisissant un petit volume de départ du liquide de prélèvement (tel que 5 ml), puis en prenant une petit aliquot d’environ 150 μL pour l’extraction de l’ADN ou de l’ARN.
5/ ANALYSE DES ÉCHANTILLONS avec des techniques de microbiologie rapide
Les échantillons obtenus avec le Coriolis µ et le Coriolis Compact, étant sous forme liquide, sont compatibles avec toutes les techniques de microbiologie rapide, telles que qPCR, RT-qPCR, microarrays. Les échantillons peuvent également être analysés avec des biotests de viabilité. Il a été démontré que les échantillonneurs d’air liquide sont moins susceptibles d’endommager les virus lors de l’échantillonnage que les échantillonneurs d’air sec, ce qui implique qu’ils sont plus adaptés aux études de viabilité virale.
6/ DÉCONTAMINATION : décontaminez le Coriolis après chaque expérience
L’appareil Coriolis µ doit être décontaminé après chaque expérience. La canne, la prise d’air et les cônes d’échantillonnage peuvent être stérilisés en autoclave. Une solution alternative consiste à faire tremper ces pièces dans une solution d’eau de Javel commerciale. Comme la plupart des concentrations d’eau de Javel du commerce varient entre 5,25 % et 8,25 %, une dilution de 1 part d’eau de Javel pour 49 parts d’eau donnera une solution désinfectante appropriée. La canne et la prise d’air peuvent également être nettoyées avec de l’éthanol à 70 % entre chaque prélèvement. Ces solutions peuvent être utilisées pour nettoyer les parties externes de l’échantillonneur d’air Coriolis en étant appliquées à l’aide d’une éponge humide ou d’un chiffon.
Le corps principal de l’échantillonneur d’air Coriolis μ peut être décontaminée à l’aide de vapeur de peroxyde d’hydrogène (H202) en faisant fonctionner l’appareil en mode Décontamination.
Autrement, pour le prélèvement de virus, l’unité principale peut être décontaminée en la faisant fonctionner avec un cône rempli d’éthanol pendant 15 min à 300 L/min dans une pièce ventilée. Cela générera un aérosol d’éthanol qui désinfectera le moteur principal du Coriolis. En effet, l’éthanol à 70 % est un désinfectant bien connu qui s’est avéré efficace sur les virus même à des concentrations plus faibles. Il est à noter que si cette opération détruira tous les virus, les spores ne seront pas éliminées.
Toutes les procédures de manipulation des produits chimiques et de décontamination doivent également suivre les consignes de sécurité du laboratoire de l’utilisateur (concernant les équipements de protection…).